Środek lata to dobry czas, by napisać coś o ozonie.
Ozon to tzw. odmiana alotropowa tlenu. „Normalna” cząsteczka tlenu składa się z dwóch atomów tego pierwiastka (wzór chemiczny O2), cząsteczka ozonu zaś z trzech (O3). Dodatkowy atom tlenu łatwo się odłącza, dlatego ozon chętnie wchodzi w reakcje chemiczne, jest silnym utleniaczem.
Wiele osób kojarzy ozon przede wszystkim z chroniącą nas przed promieniowaniem ultrafioletowym warstwą ozonową i problemem „dziury ozonowej”. To dobre skojarzenie. Tyle że warstwa ozonowa znajduje się w stratosferze (w zależności od szerokości geograficznej od 12 do 30 km nad powierzchnią Ziemi). A nas tu akurat bardziej interesuje ozon występujący przy powierzchni ziemi, czyli tzw. ozon troposferyczny.
Dlaczego powinniśmy interesować się ozonem?
Przede wszystkim dlatego, że szkodzi on naszemu zdrowiu. A także dlatego, że szkodzi roślinom, w tym roślinom uprawnym, co może wpływać na wysokość plonów. Wreszcie dlatego, że jest ważnym gazem cieplarnianym.
Czytaj także: Ozon: groźny dla dzieci, osób starszych i astmatyków
Ozon w atmosferze
Skąd bierze się ozon w dolnych warstwach atmosfery? Część spływa ze stratosfery, ale część powstaje z innych zanieczyszczeń w reakcjach chemicznych zachodzących pod wpływem światła słonecznego. Te „inne zanieczyszczenia”, tzw. prekursory ozonu, to przede wszystkim dwutlenek azotu (NO2), tlenek węgla (CO) i metan (CH4). A także lotne związki organiczne (LZO, ang. volatile organic compounds, VOCs) – na przykład niedopalone składniki benzyny czy oleju napędowego. Ale również węglowodory pochodzące ze źródeł naturalnych, choćby emitowane przez rośliny związki z grupy izoprenów.
Powstawanie ozonu
Mam nadzieję, że nie zniechęca Państwa ta odrobina chemii. Ani nawet równania reakcji chemicznych.
Podstawowe reakcje prowadzące do powstawania ozonu są następujące: pod wpływem światła ultrafioletowego dwutlenek azotu rozpada się na tlenek azotu i rodnik tlenowy (tlen atomowy),
NO2 + hν → NO + O,
gdzie hν to wyrażenie na energię fotonu, czyli kwantu promieniowania, tu akurat ultrafioletowego. W zapisie reakcji takie „hν” (czytaj „ha ni”, h to stała Plancka, a ν częstość promieniowania) symbolizuje po prostu foton, czyli reakcja wyżej opisuje oddziaływanie fotonu z cząsteczką NO2.
Dalej, tlen atomowy reaguje z tlenem cząsteczkowym dając ozon:
O + O2 → O3.
Dlatego właśnie stężenia ozonu są duże, kiedy mocno świeci słońce: w ciągu roku na wiosnę i w lecie, zaś w ciągu doby sytuacja często wygląda z grubsza tak jak na załączonym wykresie:
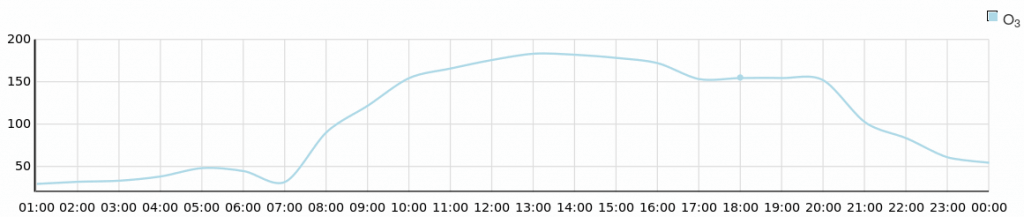
Stężenia ozonu mierzone na stacji Konstancin-Jeziorna 5 lipca 2018. Źródło: Wojewódzki Inspektorat Ochrony Środowiska w Warszawie.
Widać, że od rana stężenie gwałtownie rośnie gdzieś do wczesnego popołudnia, a mocno spadać zaczyna dopiero wieczorem.
W pokazanych wyżej reakcjach nigdzie nie występują wspomniane wcześniej LZO, metan i tlenek węgla. Biorą one jednak udział w innych reakcjach chemicznych, a ich obecność zwiększa stosunek stężenia NO2 do stężenia NO. Sprawia to, że powstawanie ozonu z dwutlenku azotu jest bardziej wydajne.
Co ciekawe w pobliżu ruchliwych ulic, gdzie w powietrzu jest dużo tlenku azotu (NO), ozonu jest mniej niż z dala od miejsc z intensywnym ruchem samochodów. Dlaczego? Bo ozon reaguje z NO:
NO + O3 → NO2 + O2.
Zjawisko to po angielsku określane jest trudnym do zgrabnego przetłumaczenia terminem scavenging (czyszczenie?) I dlatego na stacjach komunikacyjnych, np. na al. Niepodległości w Warszawie lub al. Krasińskiego w Krakowie ozon w ogóle nie jest mierzony. Jest za to mierzony na stacjach tła miejskiego i regionalnego.
Co robić, by ozonu w powietrzu było mniej?
Na nasłonecznienie wielkiego wpływu nie mamy. Trzeba więc zmniejszać stężenia prekursorów ozonu, w tym dwutlenku azotu. Za emisję NO2 odpowiadają w Polsce przede wszystkim – mniej więcej po równo – energetyka i transport: silniki spalinowe, zwłaszcza silniki Diesla.
Poznaj również niezbędne informacje dotyczące szkodliwości dwutlenku azotu w powietrzu.
Za emisję tlenku węgla i lotnych związków organicznych – także przede wszystkim motoryzacja, przynajmniej w interesującym nas tutaj okresie – czyli poza sezonem grzewczym. Głównymi związanymi z działalnością człowieka źródłami metanu w powietrzu są rolnictwo, emisje z kopalń węgla kamiennego i wycieki gazu ziemnego.
Prognozy dla stężeń ozonu w Europie
W wielu miejscach w Europie prognozuje się w przyszłości występowanie wyższych niż obecnie stężeń ozonu, choć tego typu szacunki obarczone są sporą niepewnością (patrz mapa EEA). Przewidywany wzrost stężeń ozonu jest jedną z licznych konsekwencji zmiany klimatu.
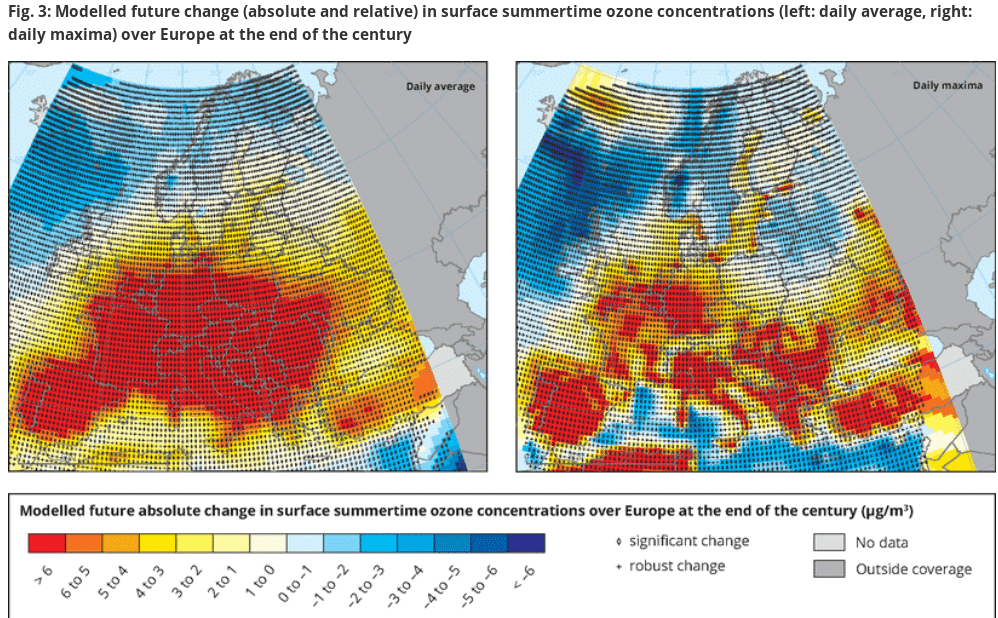
Przewidywany wzrost stężeń ozonu w Europie pod koniec stulecia. Źródło: Europejska Agencja Środowiska.
Literatura:
Daniel A. Vallero. Fundamentals of Air Pollution (Fourth Edition)
http://www.sciencedirect.com/science/book/9780123736154
Dane Wojewódzkiego Inspektoratu Ochrony Środowiska w Warszawie :
http://sojp.wios.warszawa.pl/dane-pomiarowe/?q=type:n,site:209
Europejskia Agencja Środowiska, prognozy stężeń ozonu dla Europy w przyszłości:
https://www.eea.europa.eu/data-and-maps/indicators/air-pollution-by-ozone-2/assessment
Fot. Bluebells 2008/Flickr.




















